M.D.M PUBLIC SCHOOL JANI KHURD
HOME ASSIGNMENT
SESSION – 2020 – 2021
CLASS – 10th
SUBJECT – CHEMISTRY
SUBJECT TEACHER - RAJ KUMAR SIR
SUBJECT TEACHER - RAJ KUMAR SIR
पाठ-2 अम्ल व क्षार (ACID AND BASE)
अम्ल और क्षार
ACID AND BSE
ACID AND BSE
अम्ल (ACID) :- (पुरानी धारणा) वे पदार्थ जो स्वाद मे खट्टे होते है , जो नीले लिटमस को लाल कर देते है अम्ल कहलाते है |
जैसे :- सिरका ,निम्बू ,कच्चा आम ,इमली आदि |
सीमाएँ :- यह धारणा पूर्ण रूप से चल नहीं सकी क्योकि कुछ पदार्थ इस धारणा का पालन नहीं करते है |
अम्लों के प्रकार
आयनन के आधार पर
सीमाएँ :- यह धारणा पूर्ण रूप से चल नहीं सकी क्योकि कुछ पदार्थ इस धारणा का पालन नहीं करते है |
आरहेनियस के अनुसार :- अम्ल वे पदार्थ है जो जलीय विलयन मे (H +) हाइड्रोजन आयन देते है , ये स्वाद मे खट्टे होते है |
जैसे :- H2SO4 , HCl , HNO3
अम्ल तथा उनके स्त्रोत :
अम्लों के प्रकार
आयनन के आधार पर
आयनन के आधार पर अम्ल दो प्रकार के होते है -
(1) प्रबल अम्ल (STRONG ACID) :- वे अम्ल जो जल में पूर्णतया आयनित या वियोजित होते है , प्रबल अम्ल कहलाते है | सामान्यत: खनिज अम्ल प्रबल अम्ल होते है |
जैसे :- H2SO4 , HCl , HNO3
(2) दुर्बल अम्ल (Weak Acid) :- वे अम्ल , जो जल मे पूर्णत: वियोजित या आयनित नहीं होते है , दुर्बल अम्ल कहलाते है | सामान्यत: पादपों से प्राप्त अम्ल दुर्बल होते है |
जैसे :- HCN , CH3COOH , HCOOH आदि |
सांद्रता आधार पर वर्गीकरण
सांद्रता के आधार पर भी अम्ल दो प्रकार के होते है -
(1) सान्द्र अम्ल(CON. ACID) :- जिसमे अम्ल ज्यादा हो और जल की मात्रा कम हो , सान्द्र अम्ल कहलाता है |
(2) तनु अम्ल (DILL. ACID) :- जिसमे अम्ल कम मात्रा अधिक हो और जल ज्यादा मात्रा कम हो , तनु अम्ल कहलाता है |
अम्लों के सामान्य गुण -
- ये स्वाद मे खट्टे होते है |
- ये नीले लिटमस को लाल कर देते है |
- ये जलीय विलयन मे (H+) आयन देते है |
- सभी खट्टे फलो मे अम्ल होता है |
- प्रबल अम्ल प्रबल संक्षारक होते है |
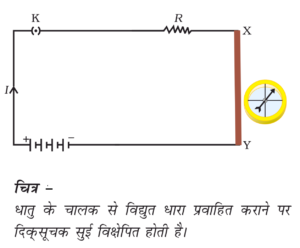
- वैधुत चालकता :- अम्लों का जलीय विलयन विद्युत का चालक होता है , क्योंकि अम्लों मे ( H+ ) आयन होता है |
- क्षारो से अभिक्रिया :- अम्ल क्षारो से अभिक्रिया करके उनके प्रभाव को ख़तम कर देते है और लवण व जल है , इस प्रक्रिया को उदासीनीकरण अभिक्रिया कहते है |
अम्ल + क्षार → लवण + जल
HCl + NaOH → NaCl + H2O
- धातु कार्बोनेटो व धातु बाइकार्बोनेटो से क्रिया :- अम्ल धातु कार्बोनेटो व धातु बाइकार्बोनेटो से क्रिया करके लवण , कार्बन डाई ऑक्साइड व जल बनते है |
धातु कार्बोनेटो व धातु बाइकार्बोनेटो + अम्ल → लवण + कार्बन डाई ऑक्साइड + जल
अम्लों के उपयोग :-
- सल्फ्यूरिक अम्ल का उपयोग लैड बैटरियों मे , पेट्रोलियम उद्योग मे , प्लास्टिक , कृत्रिम रेशे बनाने , उर्वरक निर्माण , आदि मे प्रयुक्त किया जाता है |
- नाइट्रिक अम्ल का उपयोग सोने चाँदी के सोधन में किया जाता है | उर्वरक , ओषधि , विस्फोटक बनाए मे किया जाता है |
- हाइड्रोक्लोरिक अम्ल का उपयोग वस्त्र उद्योग मे किया जाता है |
- कपड़ा से जंग के दाग धब्बे हटाने के लिए ऑक्जेलिक अम्ल का प्रयोग किया जाता है।
- HCL खाना पचाने में सहायक होता है जो हमारे अमाशय की ग्रंथियों से स्रावित होता है।
- HCL का उपयोग स्टार्च से ग्लूकोज बनाने में उत्प्रेरक रूप में होता है।
★ अम्लों में सबसे शक्तिशाली अपचायक नाइट्रिक एसिड (HNO3) है।
क्षारक (Base) :- (पुरानी अविधारणा) वे पदार्थ जिनका स्वाद तीक्ष्ण कड़वा होता है जो लाल लिटमस को नीला कर देते है क्षारक कहलाते है |
जैसे :- साबुन , कास्टिक सोडा , धावन सोडा आदि |
सीमाएँ :- यह धारणा पूर्ण रूप से चल नहीं सकी क्योकि कुछ पदार्थ इस धारणा का पालन नहीं करते है |
आरहेनियस के अनुसार :- वे पदार्थ जो आयनन के बाद जल मे वियोजित होकर हाइड्रोक्साइड आयन (OH-) देते है , क्षार या क्षारक कहलाते है | क्षारक लाल लिटमस को नीला कर देते है |
नोट :- वे क्षारक जो जल मे घुल जाते है क्षार कहलाते है |
अत: सभी क्षार , क्षारक होते है किन्तु सभी क्षारक , क्षार नहीं होते है |
क्षारको के प्रकार
आयनन के आधार पर
आयनन के आधार पर
आयनन के आधार पर क्षारक दो प्रकार के होते है -
(1) प्रबल क्षारक (Strong Base) :- वे क्षारक जो जल में पूर्णतया आयनित या वियोजित होते है , प्रबल क्षारक कहलाते है |
जैसे :- KOH , NaOH ,Ba(OH)2
(2) दुर्बल क्षारक (Weak Base) :- वे क्षारक , जो जल मे पूर्णत: वियोजित या आयनित नहीं होते है , दुर्बल क्षारक कहलाते है |
जैसे :- NH4OH , Al(OH)3
सांद्रता आधार पर वर्गीकरण
सांद्रता के आधार पर भी क्षारक दो प्रकार के होते है -
(1) सान्द्र क्षारक (CON. BASE):- जिसमे क्षारक ज्यादा हो और जल काम मात्रा मे हो , सान्द्र क्षारक कहलाता है |
(2) तनु क्षारक (DILL. BASE) :- जिसमे क्षारक कम मात्रा मे हो और जल मे हो , तनु क्षारक है |
क्षारको के सामान्य गुण :-
- क्षारक स्वाद मे तीक्ष्ण या कड़वे होते है |
- क्षारक लाल लिटमस को नीला कर देते है |
- ये जल मे वियोजित होकर हाइड्रॉक्साइड आयन (OH-) देते है |
- प्रबल क्षारक प्रबल संक्षारक होते है |
- क्षारक स्पर्श करने पर साबुन जैसे चिकने होते है |
- वसा व तैलो से क्रिया करके क्षारक साबुन व गिलसरोल बनाते है |
- धातुओं से क्रिया :- जब क्षारक धातुओं से क्रिया करते है तो लवण व हाइड्रोजन गैस बनते है |
धातु + क्षारक → लवण + हाइड्रोजन गैस
Zn + 2NaOH → Na2ZnO2 + H2
- अम्लों के साथ क्रिया :- क्षारक अम्लों से अभिक्रिया करके उनके प्रभाव को ख़तम कर देते है और लवण व जल है , इस प्रक्रिया को उदासीनीकरण अभिक्रिया कहते है |
अम्ल + क्षार → लवण + जल
HCl + NaOH → NaCl + H2O
- वैधुत चालकता :- अम्लों की तरह क्षारको के जलीय विलयनों मे भी आयन होते है जिनके कारण इनमे विद्युत प्रवाहित होती है |
क्षारको के उपयोग :-
- साबुन बनाने मे |
- वस्त्रो की रंगाई मे |
- कागज उद्योग मे |
- चमड़ा उद्योग मे , खारे जल को मृदु बनाने मे , ब्लीचिंग पाउडर बनाने मे |
सूचक (INDICATOR) :- सूचक वे पदार्थ होते है जो किसी पदार्थ की अम्लीय या क्षारीय प्रकृति का ज्ञान करते है |
दूसरे शब्दों मे , वे पदार्थ जो अम्लीय व क्षारीय विलयनों मे अपना रंग या गंध बदल देते है , अम्लीय क्षारीय सूचक कहलाते है |
जैसे :- लिटमस , मिथाइल ऑरेंज , फिनॉलफ्थलीन , हल्दी, आदि |
कुछ मुख्य सूचक इस प्रकार है -
(1) लिटमस (Litmus) :- लिटमस विलयन बैंगनी रंग का सूचक होता है | जो थैलाफाइटा समूह के लिचेन पौधे से निकाला जाता है |
जब लिटमस को अम्ल मे मिलाया जाता है तो यह लाल हो जाता है और यदि क्षार मे मिलाया जाता है तो नीला हो जाता है |
लिटमस विलयन → बैंगनी
लिटमस विलयन + अम्ल → लाल
लिटमस विलयन + क्षार → नीला
नोट :- लिटमस पेपर , कागज की पतली पट्टी को लिटमस विलयन में भिगोकर बनाया जाता है |
(1) मिथाइल ऑरेंज :- मिथाइल ऑरेंज नारंगी रंग का रंजक है | जब मिथाइल की एक बून्द अम्लीय विलयन मे मिलायी जाती है , तो विलयन का रंग लाल हो जाता है | और क्षार में मिलाने पर विलयन का रंग पीला हो जाता है |
मिथाइल ऑरेंज ( उदासीन ) → नारंगी
मिथाइल ऑरेंज + अम्लीय विलयन → लाल रंग
मिथाइल ऑरेंज + क्षारीय विलयन → पीला रंग
(2) फिनॉलफ्थलीन (Phenolphthalin) :- फिनॉलफ्थलीन एक रंगहीन पदार्थ है | अम्लीय विलयन मे रंगहीन रहता है , जबकि फिनॉफ्थलीन की एक बूँद क्षारकीय विलयन में मिलाने पर गुलाबी ह जाता है |
फिनॉलफ्थलीन ( उदासीन ) → रंगहीन
फिनॉलफ्थलीन + अम्लीय विलयन → रंगहीन
फिनॉलफ्थलीन + क्षारीय विलयन → गुलाबी
(3) गांधीय सूचक (Olfactory Indicators) :- कुछ ऐसे पदार्थ होते है जिनकी गंध अम्लीय या क्षारीय माध्यम मे बदल जाती है | ऐसे गांधीय सूचक कहलाते है |
(4) हल्दी :- हल्दी भारतीय भारतीय रसोई मे प्रयोग होने वाला प्रमुख मसाला है हल्दी पिले रंग की होती है जोकि क्षारकीय विलयन में लाल हो जाती है |
हल्दी रंग का पाउडर → पीला
हल्दी + क्षारीय विलयन → लाल
अम्ल व क्षारो की प्रबलता :- किसी अम्ल या क्षार प्रबलता उसके द्वारा उत्पन्न H + आयन या OH - आयन की संख्या करती है | किसी अम्ल या क्षार की प्रबलता हम सारभौमिक सूचक द्वारा ज्ञात कर सकते है |
pH मान ( pH Value ) :-
सोरेन्स ने बताया कि किसी विलयन में उपस्थित हाइड्रोजन आयन सांद्रता के ऋणात्मक लघुगणक को उस विलयन का pH मान कहते है |
pH = -log10[H+]
लवण (SALT)
वे पदार्थ , जिनके जलीय विलयन मे हाइड्रोजन आयन (H+) के अतिरिक्त कोई अन्य धनायन तथा हाइड्रॉक्सिल आयन (OH-) के अतिरिक्त कोई अन्य ऋणायन हो , लवण कहलाते है |
दूसरे शब्दों मे , किसी अम्ल तथा क्षार को उदासीनीकरण अभिक्रिया से प्राप्त आयनिक ठोस को लवण कहते है | इस अभिक्रिया के फलस्वरूप जल का निर्माण भी होता है |
अम्ल + क्षार → लवण + जल
HCl + NaOH → NaCl + H2O
पाठ - 1 रासायनिक अभिक्रियाएँ और समीकरण - CLICK HERE
कुछ लवण निम्न लिखित है -
सल्फेट लवण - K2SO4 , Na2SO4 , CaSO4 , MgSO4 , CuSO4
सोडियम लवण - Na2SO4 , NaCl , Na2CO3
क्लोराइड लवण - NaCl , NH4Cl
साधारण नमक ( सोडियम क्लोराइड )
रासायनिक नाम - सोडियम क्लोराइड
सामान्य नाम - साधारण नमक
अणुसूत्र - NaCl
सामान्य नाम - साधारण नमक
अणुसूत्र - NaCl
बनाने की विधि :- हाइड्रोक्लोरिक अम्ल एवं सोडियम हाइड्रोक्साइड के विलयन की अभिक्रिया से NaCl बनता है , ऐसे सधारण नमक भी कहते है| ऐसे समुंद्री जल से भी प्राप्त किया जाता है |
HCl + NaOH → NaCl + H2O
उपयोग :-
- साधारण नमक का उपयोग खाने मे किया जाता है |
- NaCl का उपयोग सोडियम हाइड्रॉक्साइड , बैंकिंग सोडा , वासिंग सोडा , विरंजक चूर्ण बनाने में किया जाता है |
सोडियम हाइड्रॉक्साइड
रासायनिक नाम - सोडियम हाइड्रोक्साइड
साधारण नाम - कास्टिक सोडा
अणुसूत्र - NaOH
सोडियम हाइड्रॉक्साइड का सामान्य नाम कास्टिक सोडा है | इसका रासायनिक सूत्र NaOH है |
साधारण नाम - कास्टिक सोडा
अणुसूत्र - NaOH
सोडियम हाइड्रॉक्साइड का सामान्य नाम कास्टिक सोडा है | इसका रासायनिक सूत्र NaOH है |
बनाने की विधि :- सोडियम क्लोराइड के जलीय विलयन मे विद्युत धारा प्रवाहित करने से सोडियम हाइड्रॉक्साइड (NaOH) प्राप्त होता है |
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + Cl2 (g) + H2 (g)
सोडियम हाइड्रॉक्साइड के उपयोग :-
(i) साबुन तथा अपमार्जक बनाने मे |
(ii) कागज उद्योग व कृत्रिम फाइबर बनाने मे |
(iii) धातुओं से ग्रीस हटाने मे |
विरंजक चूर्ण
रासायनिक नाम - कैल्सियम हाइपो क्लोराइट
साधारण नाम - विरंजक चूर्ण
अणुसूत्र - CaOCl2
इसका रासायनिक नाम कैल्सियम हाइपो क्लोराइट व रासायनिक नाम CaOCl2
साधारण नाम - विरंजक चूर्ण
अणुसूत्र - CaOCl2
इसका रासायनिक नाम कैल्सियम हाइपो क्लोराइट व रासायनिक नाम CaOCl2
है |
बनाने की विधि :- विरंजक चूर्ण का निर्माण शुष्क बुझे चुने पर क्लोरीन की क्रिया से किया जाता है |
Ca(OH)2 + Cl2 → CaOCl2 + H2O
विरंजक चूर्ण गुण :-
- यह हल्के पिले रंग का चूर्ण है |
- यह जल में कम विलय है |
- इसमें क्लोरीन जैसी गन्ध आती है |
- यह तनु अम्ल से क्रिया करके क्लोरीन गैस निकलता है |
- गरम जल से क्रिया :-
CaOCl2 + H2O → Ca(OH)2 + Cl2
- ऊष्मा का प्रभाव :-
CaOCl2 → CaCl2 + O2
उपयोग :-
(1) पेयजल को जीवाणु रहित बनाने मे |
(2) जल को रोगाणु नाशक बनाने मे |
(3) सूत लकड़ी की लुगदी आदि का रंग उड़ने मे विरंजक |
(4) क्लोरोफॉर्म बनाने मे , चीनी को सफ़ेद करने तथा ऑक्सीकारक के रूप मे |
बेंकिंग सोडा (खाने का सोडा)
या रासायनिक नाम - सोडियम बाईकार्बोनेट
साधारण नाम - बेंकिंग सोडा (खाने का सोडा)
अणुसूत्र - NaHCO3
इस योगिक का रासायनिक नाम सोडियम हाइड्रोजन कार्बोनेट (सोडियम बाईकार्बोनेट) व अणुसूत्र NaHCO3 है |
बनाने की विधि :- सोडियम कार्बोनेट (Na2CO3) के संतृप्त जलीय विलयन मे कार्बन डाई ऑक्साइड गैस (CO2) प्रवाहित करने पर सोडियम बाईकार्बोनेट (NaHCO3) प्राप्त होता है |
Na2CO3 + CO2 + H2O → 2NaHCO3↓
सोडियम क्लोराइड (NaCl) के जलीय विलयन मे कॉर्बन डाई ऑक्साइड (CO2) व अमोनिया गैस (NH3) प्रवाहित करके सोडियम बाई कार्बोनेट (NaHCO3) प्राप्त होता है |
NaCl + H2O + CO2 + NH3 → NH4Cl + NaHCO3
गुणधर्म :-
- सोडियम बाइकार्बोनेट सफ़ेद क्रिस्टलीय ठोस है जो जल मे विलय है |
- उष्मा का प्रभाव : - 100 डिग्री C से अधिक ताप पर गर्म करने पर यह सोडियम कार्बोनेट मे परिवर्तित हो जाता है |
2NaHCO3 ∆→ Na2CO3 + CO2 + H2O
- जल अपघटन :- जल अपघटन होने पर यह क्षारीय विलयन का निर्माण करता है |
NaHCO3 + H2O ⇌ NaOH + H2CO3
- अम्लों से क्रिया :- बेकिंग सोडा (NaHCO3) की अम्लों से क्रिया करने पर लवण व कार्बन डाई ऑक्साइड (CO2) का निर्माण होता है |
NaHCO3 + H2SO4 ⟶Na2SO4 + H2CO3 + H2O + CO2
उपयोग :-
(1) पेट की अम्लता दूर करने मे इसका उपयोग किया जाता है |
(2) चर्म रोगो के निवारण मे |
(3) प्रयोगशाला मे अभिकर्मक के रूप मे |
(4) कच्चे दूध को फटने से रोकने मे |
(5) ब्रैड बनाने मे |
धावन सोडा
रासायनिक नाम - सोडियम कार्बोनेट डेकाहाइड्रेट
साधारण नाम - धावन सोडा
अणुसूत्र - Na2CO3.10H2O
कभी कभी सोडियम बाइकार्बोनेट से भी सोडियम कार्बोनेट बनाया जाता है |
बनाने की विधि :- ( प्रयोगशाला विधि ) इस विधि मे कार्बन डाइऑक्साड को सोडियम हाइड्रोक्साड के विलयन मे प्रवाहित करने पर सोडियम कार्बोनेट का विलयन प्राप्त होता है | जिसके वाष्पीकरण द्वारा सोडियम कार्बोनेट के क्रिस्टल प्राप्त किये जाते है |
2NaOH + CO2 → Na2CO3 + H2O
2NaHCO3 ∆→ Na2CO3 + CO2 + H2O
गुणधर्म :-
- यह एक सफ़ेद क्रिस्टलीय ठोस पदार्थ है इसका गलनांक लगभग 885 डिग्री C है |
- यह जल मे विलेय होने के बाद पर्याप्त मात्रा मे ऊष्मा उत्पन्न करता है |
- निर्जल सोडियम कार्बोनेट चूर्णित अवस्था मे होता है , ऐसे सोडा ऐश भी कहते है |
- इसके विलयन को बुझे हुए चुने के साथ गर्म करने पर कास्टिक सोडा प्राप्त होता है |
Na2CO3 + Ca(OH)2 2NaOH + CaCO3- ऊष्मा का प्रभाव :- ऊष्मा के प्रभाव से इसमें से 9 जल के अणु निकल जाते है ओर सोडियम कार्बोनेट मोनोहाइड्रेट बचता है |
Na2CO3 + Ca(OH)2 2NaOH + CaCO3
Na2CO3.10H2O Δ➝ Na2CO3.H2O + 9H2O
- कार्बन डाईऑक्साड से क्रिया :- सोडियम कार्बोनेट (Na2CO3) के संतृप्त जलीय विलयन मे कार्बन डाई ऑक्साइड गैस (CO2) प्रवाहित करने पर सोडियम बाईकार्बोनेट (NaHCO3) प्राप्त होता है |
Na2CO3 + CO2 + H2O → 2NaHCO3↓
उपयोग :-
(1) प्रयोगशाला मे अभिकर्मक के रूप मे |
(2) काँच, कागज तथा बोरेक्स उद्योग मे |
(3) पेट्रोलियम व धातु मे
नौसादर
रासायनिक नाम - अमोनियम क्लोराइड
सामान्य नाम - नौसादर
अणुसूत्र - NH4Cl
बनाने की विधि :- हाइड्रोक्लोरिक अम्ल (HCl) मे अमोनिया गैस (NH3) प्रवाहित करने पर नौसादर अमोनियम क्लोराइड (NH4Cl) प्राप्त होता है |
NH3 + HCl → NH4Cl
गुणधर्म :-
- यह एक सफ़ेद रंग का क्रिस्टलीय ठोस पदार्थ है , जो जल मे विलय है |
- ऊष्मा का प्रभाव :- गर्म करने पर इसका ऊर्ध्वपातन हो जाता है और यह अमोनिया (NH3) और हाइड्रोजन क्लोराइड (HCl) मे टूट जाता है |
NH4Cl ⇋ NH3 + HCl
NH4Cl ⇋ NH3 + HCl
- क्षारको से क्रिया :- कास्टिक सोडा व नौसादर क्रिया करने पर सोडियम क्लोराइड लवण व अमोनिया गैस निकलती है |
NH4Cl + NaOH → NaCl + H2O + NH3 ↑
NH4Cl + NaOH → NaCl + H2O + NH3 ↑
- लिथार्ज के साथ क्रिया :- नौसादर (NH4Cl) तथा लिथार्ज (PbO) की क्रिया करने पर अमोनिया (NH3) गैस बनती है |
उपयोग :-
(1) प्रयोगशाला मे अभिकर्मक के रूप मे |
(2) शुष्क शैल के निर्माण मे |
(3) बर्तनो पर कलाई व टाँका लगाने मे |
(4) कैलिको छपाई मे |
(5) अमोनिया , ओषधियों तथा उर्वरको के निर्माण मे |
प्लास्टर ऑफ़ पेरिस
रासायनिक नाम - कैल्सियम सल्फेट हेमीहाइड्रेट
सामान्य नाम - प्लास्टर ऑफ़ पेरिस
अणुसूत्र - (CaSO4)2H2O
बनाने की विधि :- जिप्सम (CaSO4.2H2O) को 373 K पर गर्म करने से प्लास्टर ऑफ़ पेरिस बनता है |
2(CaSO4.2H2O) → (CaSO4)2.H2O + 3H2O
गुणधर्म : -
- प्लास्टर ऑफ़ पेरिस एक सफ़ेद रंग का चूर्ण है जो तेज गर्म करने पर निर्जल CaSO4 मे बदल जाता है |
(CaSO4)2.H2O (तेज गर्म करने पर) → 2CaSO4 + H2O
- प्लास्टर ऑफ़ पेरिस की जल से क्रिया कराने पर ऊष्मा उत्पन्न होती है और वह शीघ्रता से जिप्सम में बदलकर जम जाता है | इस क्रिया को प्लास्टर ऑफ़ पेरिस का जमना कहते है |
(CaSO4)2 . H2O + 3H2O → 2(CaSO4 . 2H2O )
उपयोग :-
(1) शल्य चिकित्सा मे प्लास्टर करने मे |
(2) साँचे और मॉडल बनाने मे |
(3) मूर्तियाँ व खिलौने बनाने मे |
LESSON COMPLETE
- पिछला पाठ - CLICK HERE
- अगला पाठ - CLICK HERE
पाठ - 1 रासायनिक अभिक्रियाएँ और समीकरण - CLICK HERE
पाठ-2 अम्ल व क्षार ( ACID AND BASE ) - CLICK HERE
पाठ - 3 धातु और अधातु (Mattel And Non Mattel) - CLICK HERE
पाठ - 4 कार्बन व उसके यौगिक - CLICK HERE