M.D.M PUBLIC SCHOOL JANI KHURD
HOME ASSIGNMENT
SESSION – 2020 – 2021
CLASS – 10th
SUBJECT – CHEMISTRYSUBJECT TEACHER - RAJ KUMAR SIR
पाठ - 3 धातु और अधातु
धातु और अधातु
प्रस्तावना :- जैसे की आप सभी लोग जानते है कि आपके चारो तरफ बहुत से तत्व विराजमान है जिनमे से कुछ अलग - अलग से गुण के है जिनको उनके गुणो के आधार पर तीन प्रकार से बाँटा गया है , धातु , अधातु और उपधातु |
धातु (METAL) :- वे सभी तत्व जिनमे उष्मा व विद्युत धारा आसानी से प्रवाहित हो जाती हो वे सभी तत्व धातु कहलाते है | जो इलेक्ट्रान त्यागकर धनायन बनाते है , धातुए विद्युत धनात्मक होती है |
जैसे :- सोना,चाँदी,कॉपर,निकिल,कोबाल्ट , आदि |
धातुओं के भौतिक गुण :-
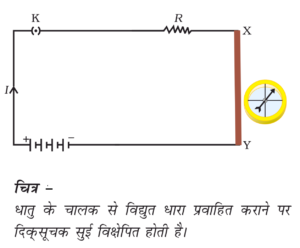
- विद्युत व ऊष्मा चालकता :- धातुओं मे मुक्त इलेक्ट्रॉन होते है इसलिए शुद्ध धातुओं में विद्युत धारा व ऊष्मा आसानी से प्रवाहित हो जाती है | जैसे : - चाँदी (Ag) , ताँबा(Cu) , सोना (Au ) , लोहा (Fe) , आदि |
- धात्विक चमक :- धातुओं मे अपनी चमक होती है ,जिसे धात्विक चमक कहते है , क्योंकि इनमे मुक्त इलेक्ट्रान होते है | जैसे : - चाँदी (Ag) , ताँबा(Cu) , सोना (Au ) , लोहा (Fe) , आदि |
- धातुए कठोर होती है | (सोडियम व पौटेशियम को छोड़कर)
- धातुए ठोस होती है | (पारे को छोड़कर)
- धातुओं मे तन्यता का गुण पाया जाता है | इनसे लम्बा तर खींचा जा सकता है |
- धातुए आघातवर्धनीय होती है |( धातुओं से पतली चादर बनाई जा सकती है )
- धातुओं को पीटने पर एक प्रकार की ध्वनि उत्पन्न होती है , इसे धात्विक ध्वनि कहते है |
- धातुओं के गलनांक व क्वथनांक उच्च होते है |
- धातुए अपारदर्शी होती है |
- धातुओं का घनत्व अधिक होता है |
धातुओं के रासायनिक गुण :- - धातुओं की ऑक्सीजन से अभिक्रिया :- धातुएँ ऑक्सीजन से क्रिया करके धातु ऑक्साइड बनती है |
धातु + ऑक्सीजन → धातु ऑक्साइड
2Mg + O2 → 2MgO
- धातुओं की अम्लों से क्रिया :- अम्ल सक्रीय धातुओं से क्रिया करके लवण व हाइड्रोजन गैस मुक्त करते है |
धातु + अम्ल → लवण + हाइड्रोजन गैस
2Na + 2HCl → 2NaCl + H2 ↑
- धातुओं की हाइड्रोजन से क्रिया :- सामान्यत: धातुए हाइड्रोजन से क्रिया नहीं करती पर कुछ धातुए जो सक्रिय है धातुओं से क्रिया कर हाइड्रेट बनती है |
धातु + हाइड्रोजन → धातु हाइड्रेड
2Na + H2 → 2NaH
- धातुओं की जल से क्रिया :- धातुओं की क्रियाशीलता के अनुसार जल से भिन्न - भिन्न तरह की क्रियाएँ दर्शाती है |
जैसे : - कुछ क्रियाशील (Na,K) धातुएँ जल से क्रिया करके धातु हाइड्रोक्साइड व हाइड्रोजन गैस बनती है |
धातु + जल → लवण + हाइड्रोजन
2Na + 2H2O → 2NaOH + H2↑
- क्लोरीन से क्रिया :- धातुए क्लोरीन से क्रिया करके धातु क्लोराइड बनाते है |
धातु + क्लोरीन → धातु क्लोराइड
2Na + Cl2 → 2NaCl
अधातुएँ (NON-METAL) :- वे पदार्थ (तत्व) जिनमे विद्युत व ऊष्मा आसानी से प्रवाहित न होती हो उन्हें अधातु कहते है | अधातुए इलेक्ट्रान ग्रहण करके ऋणायन बनाने की प्रवृति रखती है , अधातुए विद्युत ऋणात्मक होती है |
जैसे :- सल्फर , ऑक्सीजन , नाइट्रोजन आदि |
अधातुओ के गुण -
- अधातुओ मे अपनी कोई चमक नहीं होती | (ग्रेफाइट व आयोडीन को छोड़कर)
- अधातुओ मे विद्युत व ऊष्मा आसानी से प्रवाहित नहीं होती है | (ग्रेफाइट को छोड़कर )
- अधातुए मुलायम होती है | (हिरे को छोड़कर)
- अधातुए तन्य नहीं होती है |
- अधातुए आघातवर्धनीय नहीं होती |
- अधातुओ को पीटने पर ध्वनि उत्पन्न नहीं करती |
- अधातुओ के गलनांक और क्वथनांक कम होते है |
अधातुओ के रासायनिक गुण :- - अधातुओ की ऑक्सीजन से क्रिया :- अधातुएँ क्रिया करके ऑक्साइड निर्मित करती है |
अधातु + ऑक्सीजन → अधातु ऑक्साइड (उदासीन /अम्लीय )
C + O2 → CO2
- अधातुओ की जल से क्रिया :- अधातुएँ जल से क्रिया नहीं करती |
- अधातुओ की अम्लों से क्रिया :- सामान्यत : अधातुएँ अम्लों से अभिक्रिया प्रदर्शित नहीं करती |
- अधातुओ की क्लोरीन से क्रिया :- अधातुएँ क्लोरीन से क्रिया करने पर क्लोराइड बनती है |
अधातु + क्लोरीन → अधातु क्लोराइड
P4 + 6Cl2 → 4PCl3
- अधातुओ की हाइड्रोजन से क्रिया :- अधातुएँ हाइड्रोजन से क्रिया करने पर हाइड्राइड बनती है |
अधातु + हाइड्रोजन → अधातु हाइड्राइड
उपधातु :- ऐसे तत्व जिनमे धातु एवं अधातु दोनों के रासायनिक गुणधर्म पाए जाते है उपधातु कहलाते है |
दूसरे सब्दो मे , ऐसे तत्व जो भिन्न- भिन्न रासायनिक क्रियाओ में इलेक्ट्रान ग्रहण करने तथा त्यागने , दोनों की प्रवृति रखते है |
जैसे :-एंटिमनी (Sb),आर्सेनिक (As) , सिलिकॉन (Si) , जर्मेनियम (Ge) आदि |
मिश्रधातु :- दो या दो से अधिक धातुओं (एक धातु या एक अधातु ) को गलित अवस्था मे मिश्रित करने पर निर्मित समांगी मिश्रण को मिश्रधातु कहते है | मिश्रधातुए गलित धातुओं को उचित मात्रा मे मिलाकर ठण्डा करने पर प्राप्त होती है |
````````````````
जैसे :- पीतल , काँसा आदि |
धातुएँ अधातुओ से क्रिया कैसे करती है -
हम जानते है कि अक्रिय गैसों को छोड़कर बाकि सभी तत्वों मे या तो इलेक्ट्रोनो की अधिकता या कमी होती है , और तत्व स्थाई होना चाहते है उसके लिए सभी तत्वों की अंतिम कक्षा मे 8 इलेक्ट्रान करने होते है उसके लिए ये सभी तत्व इलेक्ट्रोनो साझा करते है जो निम्न प्रकार होता है |
(1) वैद्युत संयोजकता :- इस तरह की संयोजकता मे कोई परमाणु किसी दूसरे परमाणु को एक या अधिक इलेक्ट्रान पूर्ण रूप से दे देता है | इस तरह बने यौगिक को आयनिक या वैद्युत संयोजी यौगिक कहते है |
6 लाइन छोड़ दे |
(2) सहसंयोजकता :- ऐसी साझेदारी जिसमे परमाणु बराबर इलेक्ट्रॉनों की साझेदारी करते हो , सहसंयोजकता कहलाती है | इस तरह बने यौगिक को सहसंयोजी यौगिक कहते है |
6 लाइन छोड़ दे |
(3) उपसहसंयोजकता :- ऐसी साझेदारी जिसमे साझे का इलेक्ट्रान युग्म किसी एक परमाणु द्वारा किसी दूसरे परमाणु को दिया जाता है , उपसहसंयोजकता कहलाती है |
6 लाइन छोड़ दे |
धातुओं की मुक्त व संयुक्त अवस्था
प्रकृति मे धातुएँ दो अवस्थाओ मे पायी जाती है -
मुक्त अवस्था :- वे ठोस धातुए जो कम क्रियाशील है , प्रकृति मे मुक्त अवस्था मे पायी जाती है |
जैसे - सोना (Au) , चाँदी (Ag) , प्लैटिनम (Pt) आदि |
संयुक्त अवस्था :- वे ठोस धातुए जो क्रियाशील है , प्रकृति में संयुक्त अवस्था मे पायी जाती है |
जैसे :- सोडियम (Na) , कैल्सियम (Ca), आयरन (Fe) , आदि |
कुछ धातुए ऐसी है जो मुक्त व संयुक्त दोनों अवस्थाओ मे पायी जाती है |
जैसे :- कॉपर (Cu), चाँदी (Ag ), आयरन (Fe) आदि |
खनिज :- प्रकृति मे धातुएँ जिन यौगिकों के रूप मे पाई जाती है , वे खनिज कहलाते है | ये समान्यत मिटटी , कंकड़ , पत्थर , रेत , आदि के साथ मिश्रित अवस्था मे होती है |
जैसे - कॉपर पाइराइट (CuFeS2)
अयस्क :- वे खनिज जिनसे शुद्ध धातु सरलता पूर्वक कम खर्च मे प्राप्त की जाती है , अयस्क कहलाते है |
जैसे :- हार्न सिल्वर (AgCl) , कॉपर पाइराइट (CuFeS2) , आदि |
कुछ प्रमुख अयस्क
●सोडियम (Na)
बोरेक्स (सुहागा)[Na2B4O7.10H2O]
साधारण नमक(NaCl)
●एलुमिनियम (Al)
बॉक्साइट(Al2O3.2H2O)
कोरंडम(Al2O3)क्रायोलाइट(Na3AlF6)
●पोटैशियम (K)
नाइट्रेट (साल्टपीटर)[KNO3]
●कैल्सियम (Ca)
कैलसाइट(CaCO3)
जिप्सम(CaSO4.2H2O)
फ्लुओरस्पार(CaF2)
●कॉपर (Cu)
क्यूप्राइट(Cu2O)
कॉपर ग्लान्स(Cu2S)
कॉपर पाइराइट(CuFeS2)
●सिल्वर (Ag)
रूबी सिल्वर(3Ag2S.Sb2S3)
हॉर्न सिल्वर(AgCl)
●सोना (Au)
कैल्वेराइट(AuTe2)
सिल्वेनाइट[(Ag.Au)Te2]
●सीसा (Pb)
गैलेना(PbS)
●लोहा (Fe)
हेमाटाइट(Fe2O3)
लीमोनाइट(2Fe2O3.3H2O)
मैग्नेटाइट(Fe3O4)
आयरन पाइराइट(FeS2)
कॉपर पाइराइट(CuFeS2)
नोट :- जो अयस्क इस रंग के है उन्हें याद कर ले |
आधात्री अथवा मैट्रिक्स :- खनिज मे धातु या उसके यौगिक के साथ अशुद्धियों के रूप मे कंकड़ , बालू , मिटटी , आदि मिश्रित रहते है , अशुद्धियों को आधात्री अथवा मैट्रिक्स कहते है |
धातुकर्म :- अयस्कों से विभिन्न भौतिक एवं रासायनिक क्रियाओ द्वारा शुद्ध धातु प्राप्त करने की प्रक्रिया को धातुकर्म कहते है |
धातुकर्म मे प्रयुक्त प्रक्रम :- (1) अयस्क का पीसना :- खानो से प्राप्त अयस्क बड़े बड़े टुकड़ो के रूप मे होता है पहले इसे तोड़कर छोटे टुकड़ो मे बदला जाता है | इस कार्य को स्टेम्प मिल की सहायता से किया जाता है |
(2) अयस्क का सांद्रण :- अयस्क को आधात्री से अलग करना , अयस्क का सांद्रण कहलाता है | सांद्रण की कई विधियाँ होती है | जो अयस्क की और उसमे उपस्थित आधात्री की प्रकृति पर निर्भर करती है सांद्रण की कुछ प्रमुख विधिया निम्न है -
(a) गुरुत्वीय पृथक्करण विधि :- यह विधि अयस्क और उसमे उपस्थित आधात्री के आपेक्षिक घनत्वों के अंतर पर निर्भर करती है | इस विधि मे बारीक़ पिसे हुए अयस्क को जल की तेज धारा के द्वारा धोया जाता है | हल्की अशुद्धियाँ जल के साथ बह जाती है , इस विधि द्वारा भारी अयस्कों का सांद्रण किया जाता है |
जैसे :- SnO2 , Fe3O4
(b) फेन (झाग) प्लावन विधि :- इस विधि द्वारा सल्फाइड अयस्कों का सांद्रण किया जाता है | इस विधि मे एक लोहे का टैंक लिया जाता है जिसमे पानी भर लिया जाता है , और साथ ही उसमे चीड़ या तारपीन का तैल डाल दिया जाता है | इस टैंक मे एक पाइप इस प्रकार लगाया जाता है उससे वायु के तेज झोके इसमें प्रवाहित किये जा सके | इसमें वायु के तेज झोंके प्रवाहित करने पर अशुद्धियाँ टैंक की तली मे नीचे बैठ जाती है व अयस्क ऊपर झाग की रूप मे आ जाता है |
(c) चुम्बकीय पृथक्करण विधि :- यह विधि पदार्थो के चुम्बकीय गुणों पर निर्भर करती है | यदि अयस्क चुम्बकीय है या उसमे चुम्बकीय अशुद्धियाँ हो तो इस विधि का प्रयोग किया जाता है | इस विधि मे दो रोलर वाली एक मशीन होती है | जिसमे एक लोहचुम्बकीय व एक अचुम्बकीय होता है , जिन पर एक बेल्ट चढ़ी होती है |
(3) धातु का निष्कर्षण :- सांद्रित अयस्क से धातु प्राप्त करने की सम्पूर्ण क्रिया को धातु का निष्कर्षण कहते है | सान्द्रण के बाद भी अयस्क में उपस्थित सभी अशुद्धियाँ पृथक्क नहीं हो पाती है | सांद्रित अयस्को से धातुओं का निष्कर्षण अयस्क मे उपस्थित अशुद्धियों तथा उनकी प्रकृति पर निर्भर करता है | धातु निष्कर्षण में सामान्यत: प्रयुक्त होने वाले कुछ पद निम्नलिखित है -
(a) निस्तापन :- इस क्रिया में सांद्रित अयस्क को उसके गलनांक के नीचे उस ताप तक गर्म किया जाता है कि उसमे से नमी , हाइड्रेशन जल व अन्य वाष्पशील पदार्थ निकल जाते है , परन्तु अयस्क पिंघले ना , निस्तापन प्रक्रम के फलस्वरूप अयस्क शून्य तथा छिद्रमय हो जाता है | प्राय: कार्बोनेट , ऑक्साइड तथा हाइड्रोक्साइड अयस्कों का निस्तापन किया जाता है |
जैसे :- बॉक्साइट(Al2O3.2H2O) का निस्तापन करने पर उसमे उपस्थित हाइड्रेशन जल बाहर निकल जाता है |
Al2O3.2H2O → Al2O3 + 2H2O↑
(b) भर्जन या जारण :- सान्द्रित अयस्क को अकेले या किसी अन्य पदार्थो के साथ मिलकर वायु की नियंत्रित मात्रा की उपस्थिति मे बिना पिंघलए गर्म करने की क्रिया को भर्जन कहते है |
यह क्रिया मुख्यत: सल्फाइड अयस्कों के लिए प्रयुक्त की जाती है | इस क्रिया में अयस्क आंशिक अथवा पूर्ण रूप से ऑक्सीकृत हो जाता है तथा अयस्क में उपस्थित सल्फर व आर्सेनिक की अशुद्धियाँ दूर हो जाती है | यह क्रिया प्राय: परावर्तनी भट्टी द्वारा की जाती है |
जैसे :- कॉपर पाइराइट(CuFeS2) का भर्जन करने पर निम्न क्रियाए होती है |
CuFeS2 + O2 → Cu2S + 2FeS + SO2↑
2Cu2S + 3O2 → 2Cu2O + 2SO2↑
2FeS + 3O2 → 2FeO + 2SO2↑
अयस्क मे उपस्थित सल्फर व आर्सेनिक की अशुद्धियाँ वाष्पशील होकर ऑक्साइडों में परिवर्तित होकर वायु के साथ बाहर निकल जाती है |
S + O2 → SO2↑
2As + 3O2 → As2O3↑
(c) प्रगलन :- निस्तापन तथा भर्जन प्रक्रिया के बाद अयस्क को कोक तथा उचित गालक के साथ मिलाकर मिश्रण को उच्च ताप पर गर्म करके गलने की प्रक्रिया को प्रगलन कहते है | प्रगलन क्रिया को वात्या भट्टी में संपन्न कराया जाता है |
इस क्रिया में कोक प्राय: अपचायक का कार्य करता है तथा अयस्क को गलित धातु में परिवर्तित कर देता है |
जैसे :- हेमाटाइट (Fe2O3) का प्रगलन
Fe2O3 + 3C 2Fe + 3CO
Fe2O3 + 3CO 2Fe + 3CO2
(3) धातु का शोधन :- अयस्क में से धातु के निष्कर्षण से प्राप्त धातु प्राय: अशुद्ध होती है | इसमें प्राय: कार्बन , सिलिकॉन ,फास्फोरस आदि की अशुद्धियाँ सम्मिलित रहती है |
किसी भी धातु के शोधन की विधि उसकी प्रकृति एवं उसमे उपस्थित अशुद्धियो की प्रकृति पर निर्भर करती है |
(1) वैधुत - अपघटनी विधि :- इस विधि में अशुद्ध धातु को एनोड तथा शुद्ध धातु को कैथोड बनाकर एक वैधुत सेल में लगा देते है | उसी धातु के किसी घुलनशील लवण का विलयन वैधुत - अपघटय के रूप में प्रयुक्त किया जाता है वैद्युत अपघटन के कारण एनोड से धातु घुलकर शुद्ध धातु कैथोड पर जमा हो जाती है , तथा अशुद्धियाँ नीचे बैठ जाती है | एल्यूमिनियम व कॉपर का शोधन इस विधि से किया जाता है |
कॉपर धातु के शोधन में कॉपर सल्फेट विलयन वैधुत - अपघटय होता है , अशुद्ध कॉपर की मोटी प्लेट एनोड का तथा शुद्ध कॉपर की पतली प्लेट कैथोड का कार्य करती है | वैधुत धारा प्रवाहित करने पर अशुद्ध कॉपर प्लेट घुलकर Cu++ आयन बनाती है | जो शुद्ध कॉपर प्लेटों पर जमता जाता है तथा अशुद्धियाँ नीचे बैठ जाती है |
M → Mx+ + xe-
(2) द्रवण विधि :- धातुओं का गलनांक अशुद्धिओ से कम होने पर इस विधि का प्रयोग किया जाता है |
जैसे :- टिन | इस विधि में धातु को गलाकर ढालू तल पर बाह देते है | चूँकि धातु का गलनांक कम होता है , अत: वह ढाल से बहकर नीचे इक्कट्ठा हो जाती है एवं अशुद्धियाँ ऊपर रह जाती है |
(3) खर्परीकरण :- वह प्रक्रम जिसके अंतर्गत , धातु की अपेक्षा अशुद्धियों का क्वथनांक अत्यंत कम होता है अर्थात अशुद्धियाँ वाष्प बनकर उड़ जाती है तथा धातु सुगमता से पृथक हो जाती है , खर्परीकरण कहलाती है |
भट्टियाँ :-
यह भट्टी अग्निसह की ईंटो की दीवारों की बनी होती है | इस भट्टी के तीन भाग होते है -
(a)अग्नि सह स्थान ( अग्निस्थान या भट्टी ) :- इस स्थान पर ईंधन जलाकर ऊष्मा प्राप्त करते है | इसकी दीवारे अग्निसह ईंटो की होती है |
(b) चूल्हा ( भट्टी का तल ) :- यहाँ गर्म करने वाले पदार्थ जाता है अर्थात धान को रखा जाता है |
(c) चिमनी :- यहाँ व्यर्थ गैसें बाहर है |
इस भट्टी में धान , ईंधन सीधे संपर्क में नहीं होता है , अत : इसका उपयोग ऑक्सीकरण व अपचयन दोनों में होता है | परावर्तनी भट्टी उपयोग अधिकांशत: निस्तापन व भर्जन में किया जाता है |
(2) वात्या भट्टी :-
यह लगभग 25 से 60 मीटर तक ऊँची चिमनी के आकर की होती है | इसकी बाहरी दीवार स्टील की बनी होती है | इसकी अंदर की दीवार अग्निसह ईंटो बनी होती है |
इसके निम्नलिखित तीन भाग होते है -
(a) हॉपर :- भट्टी के ऊपरी भाग को हॉपर कहते है | गर्म करने वाले पदार्थ अर्थात धान को हॉपर में स्थित कोन से डालते है |
(b) बॉडी और बॉश :- बॉडी और वॉश दो कोन से मिलकर बना होता है | ऊपर वाले लम्बे कोन को बॉडी तथा नीचे वाले छोटे कोन को वॉश कहते है | बॉडी के ऊपरी भाग में व्यर्थ गैसों के निष्कासन के लिए द्वार होता है |
जबकि वॉश के नीचे वाले छोर पर गर्म वायु भेजने के लिए टवीयर्स लगे होते है |
(c) चूल्हा :- यह भट्टी के सबसे निचले हिस्से मिलेगा होता है | इसमें गलित पदार्थ एकत्रित होता है | पिंघली हुई धातु एवं धातुमल के निकास हेतु नीचे की ओर दो निकास द्वार होते है |
(3) बेसेमर परिवर्तक
यह इस्तपात की चादरों का नाशपाती के आकार का बना होता है | इसके भीतर अग्नि सह ईंटो तथा लाइम या मैग्नेसाइट का अस्तर लगा होता है | इसकी बगल में काफी ऊंचाई पर ट्वियर लगा होता है |
जिसके द्वारा वायु के तेज झोंके इसमें भेजे जा सके परिवर्तक एक स्टैंड पर लगा होता है और इसको स्टैंड पर ऊपर निचे घुमाया जा सकता है इसमें पिंघला हुआ अयस्क या धातु लेकर वायु प्रवाहित करते है | अशुद्धियों के ऑक्सीकरण से पर्याप्त गर्मी पैदा होती है , अत बाहर से गर्मी नहीं दी जाती है |
धातुओं की सक्रियता श्रेणी
- धातुओं को उनकी अभिक्रियाशीलता के घटते क्रम में रखने पर जो श्रेणी प्राप्त होती है, वह सक्रियता श्रेणी कहलाती है|
- हाइड्रोजन से ऊपर स्थित धातुएँ तनु अम्लों से हाइड्रोजन विस्थापित कर देती हैं एक अधिक अभिक्रियाशील धातु, कम अभिक्रियाशील धातु को उसके लवण के विलयन से विस्थापित कर देती है |
- चांदी एवं सोना धातु अत्यंत अधिक ताप पर भी ऑक्सीजन से क्रिया नहीं करती हैं यह धातुएं जल एवं उनके साथ भी अभिक्रिया नहीं करती हैं |
- ऐक्वा-रेजिया (रॉयल जल का लैटिन शब्द) या अम्लराज 3:1 के अनुपात में सांद्र हाइड्रोक्लोरिक अम्ल एवं सांद्र नाइट्रिक अम्ल का ताजा मिश्रण होता है सोने को गला सकता है यह सोने यह प्रबल संक्षारक होता है |
- टाइटेनियम को भविष्य की धातु कहा जाता है
धातुओं की सक्रियता श्रेणी
| तत्वों के संकेत | तत्वों के नाम |
| K | पोटेशियम |
| Na | सोडियम |
| Ca | कैल्शियम |
| Mg | मैग्नीशियम |
| Al | एलुमिनियम |
| Zn | जिंक |
| Fe | आयरन |
| Pb | लेड (सीसा) |
| H | हाइड्रोजन |
| Cu | कॉपर (तांबा) |
| Hg | मरकरी (पारा) |
| Ag | चांदी (सिल्वर) |
| Au | सोना (गोल्ड) |
कुछ धातुएं ज्वाला में गर्म करने पर ज्वाला को विशिष्ट रंग प्रदान करती हैं इनका उपयोग आतिशबाजी में रंग उत्पन्न करने के लिए किया जाता है |
| धातु | ज्वाला का रंग |
| Li | लाल |
| Na | पीला |
| K | लाइलैक |
| Rb | बैंगनी |
| Cs | नीला |
| Ca | ईट जैसा लाल |
| Ba | सेब जैसा हरा |
| Sr | सुनहरा लाल रंग |
थर्मिट अभिक्रिया :- कुछ विस्थापन अभिक्रियाएँ बहुत अधिक ऊष्माक्षेपी होती है | इनसे उत्सर्जित ऊष्मा की मात्रा इतनी अधिक होती है कि धातुएँ गलित अवस्था में प्राप्त होती है | जब आयरन (III) ऑक्साइड (Fe ,O) के साथ एल्युमिनियम की अभिक्रिया की जाती है तो अत्यधिक ऊष्मा उत्पन्न होती है |
संक्षारण (Corrosion)
वह प्रक्रिया जिसमे कोई पदार्थ नमी ,वायु आदि से क्रिया करके अपनी चमक खो दे और उस पदार्थ का क्षय हो जाये , संक्षारण कहलाती है |
जैसे :- लोहे पर जंग का लगना ,चाँदी का कला पड जाना,सोने का कला पड़ जाना |
धातु जितनी ज्यादा सक्रिय होगी उसका संक्षारण उतनी ही शीघ्रता से होता है |
संक्षारण से बचाव :- संक्षारण से निम्नलिखित तरीको से बचाव किया जा सकता है -
- पेंट करके
- तेल व ग्रीस लगाकर
- गैल्वेनिकरण द्वारा
- क्रोमियम , टिन या निकिल की परत चढ़ाकर
- एनोडीकरण या मिश्रधातु बनाकर
मिश्रधातु :- जब दो या दो से अधिक धातुओं को एक निश्चित अनुपात में मिलाकर पिंघलाया जाता है तो ये धातुएँ परस्पर मिल जाती है और कमरे के ताप पर ठण्डा करने पर एक समांगी मिश्रण बनाती ऐसे मिश्रण को मिश्रधातु कहते है |
महत्वपूर्ण मिश्रधातु और उनके उपयोग की सूची
मिश्रधातु | संघटन | उपयोग |
|---|
पीतल | Cu (70%), Zn (30%) | बर्तन बनाने में |
कांसा | Cu (90%), Sn (10%) | सिक्के, घंटी और बर्तन बनाने में |
जर्मन सिल्वर | Cu (60%), Zn (20%), Ni (20%) | बर्तन बनाने में |
रोल्ड गोल्ड | Cu (90%), Al (10%) | सस्ते आभूषण बनाने में |
गन मेटल | Cu (88%), Sn (10%), Zn (1%), Pb (1%) | बंदूक, बैरल, गियर और बायरिंग बनाने में |
डेल्टा मेटल | Cu (60%), Zn (38%), Fe (2%) | हवाई जहाज के डैने (पंख) बनाने में |
मुंज मेटल | Cu (60%), Zn (40%) | सिक्के बनाने में |
डच मेटल | Cu (80%), Zn (20%) | कृत्रिम आभूषण बनाने में |
मोनल मेटल | Cu (70%), Ni (30%) | आधार वाले कंटेनर बनाने के लिए |
रोज मेटल | Bi (50%), Pb (28%), Sn (22%) | स्वचालित फ्यूज बनाने में |
सोल्डर | Pb (50%), Sn (50%) | सोल्डिंग करने में |
मैग्नेलियम | Al (95%), Mg (5%) | हवाई जहाज की बॉडी बनाने में |
ड्यूरेलुमिन | Al (94%), Cu (3%), Mg (2%), Mn (1%) | बर्तन बनाने में |
टाइप मेटल | Sn (5%), Pb (80%), Sb (15%) | प्रिंटिंग उद्योग में |
बेल मेटल | Cu (80%), Sn (20%) | घंटी और मूर्ति बनाने में |
स्टेनलेस स्टील | Fe (75%), Cr (15%), Ni (9.5%), C (.05%) | बर्तन एवं सर्जिकल औजार बनाने में |
निकेल स्टील | Fe (95%), Ni (5%) | बिजली के तार एवं वाहनों के पुर्जे बनाने में |
मिश्रधातुओं में निम्नलिखित विशेषताएं पायी जाती है-
- मिश्रधातुएँ अपनी अवयवी धातुओं से प्रायः अधिक कठोर होती हैं।
- मिश्रधातुएँ अपनी अवयवी धातुओं की अपेक्षा अधिक संक्षारणरोधी होती हैं।
- इनके गलनांक शुद्ध अवयवी धातुओं की तुलना में प्रायः कम होते हैं।
अध्याय पूरा |
CHEMISTRY FOR CLASS 9th
पाठ-१ हमारे आस पास के पदार्थ | पदार्थ (द्रव्य) क्या है ? CLASS 9TH - CLICK HERE
पाठ - 2 क्या हमारे आस - पास के पदार्थ शुद्ध है CLASS 9TH CH 2 - CLICK HERE
PHYSICS FOR CLASS 9th
पाठ - 8 गति CLASS 9TH - CLICK HERE
पाठ - 9 बल तथा गति के नियम - CLICK HERE
पाठ - 10 गुरुत्वाकर्षण (GRAVITY 9TH CLASS ) - CLICK HERE
पाठ - 11 कार्य तथा ऊर्जा (work and energy) - CLICK HERE
CHEMISTRY FOR CLASS 10th
पाठ - 1 रासायनिक अभिक्रियाएँ और समीकरण - CLICK HERE
पाठ - 1 रासायनिक अभिक्रियाएँ और समीकरण - CLICK HERE पाठ-2 अम्ल व क्षार ( ACID AND BASE ) - CLICK HERE
पाठ - 3 धातु और अधातु (Mattel And Non Mattel) - CLICK HERE